Валуев В.А. , Загорская В.В., Книсс В.А., Назаров В.С., Хабибуллин В.Ф.
Институт экологической экспертизы и биоинформационных технологий, ул. Парковая, 36, Уфа, Россия, 450571, тел.: +7(347) 270-74-19, e-mail: ValuyevVA@mail.ru
// Экология урбанизированных территорий. 2016. № 4. С. 6-11.
УДК 559.084; 97; 581.5
Valuev V.A., Zagorskaya V.V., Kniss V.A., Nazarov V.S., Khabibullin V.F.
Institute of ecological expertise and bioinformatics technologies,
Parkovaya str., 36, Ufa, Russia, 450571, tel.: +7(347)229-96-34, e-mail: ValuyevVA @mail.ru
Резюме
Изучено воздействие выделяемых озёрной лягушкой Rana ridibunda экзометаболитов на развитие корневой системы и побегов ячменя Hordeum vulgare. Выяснено, что выделяемые озёрной лягушкой в состоянии покоя в зимний период биологически активные вещества угнетающе воздействуют на зерно ячменя, понижая его всхожесть, развитие корневой системы и рост побегов. При увеличении светового дня и температуры – наоборот, они начинают действовать на его развитие как стимулирующее средство. Показано отсутствие прямой связи между концентрацией метаболитов и их влиянием на растение: наиболее активно и положительно на развитие корневой системы и побегов ячменя влияет разбавленная в 10 тысяч раз исходная жидкость.
Ключевые слова: лягушки, Rana ridibunda, кожные секреции амфибий, экзометаболиты, проростки ячменя, рост.
Resume
We studied the influence of exometabolites of pond frog Rana ridimunda on the growth of roots and springs of barley Hordeum vulgare. We have found out that metabolites of hibernating frogs inhibit the growth of barley’s seeds. On the contrary, metabolites from frogs being kept under increased temperature and daytime stimulate seeds’ growth. There are no direct correlation between concentration and influence: the most simulative effect has exometabolite/water 1:10000 solution.
Key words: frogs, Rana ridibunda, skin peptides of amphibians, exometabolites, barley sprouts, growth.
Влияние выделяемых лягушками веществ на подавление молочнокислых бактерий заметили ещё в древности. В Советском союзе активно стали их изучать с середины 1970-х годов [3-5]. В настоящее время во многих странах ведутся работы по разработке антибиотиков на основе соединений содержащихся в телах амфибий, позволяющих убивать бактерии, вирусы и грибки [2; 7; 10]. В частности, результаты таких исследований показали, что антимикробные пептиды настоящих лягушек полезны, прежде всего, как вещества, активно подавляющие различные инфекции [6]. На сегодняшний день известна противораковая, иммуномодулирующая и антимикробная активность таких пептидов [9]. Кроме того, экзометаболиты вполне применимы и в фармацевтике, прежде всего, своей избирательностью по отношению к разнообразным патогенам [11]. Вполне возможно использовать их в сельскохозяйственном производстве и пищевой промышленности [8]. Экзаметаболиты, имеющие высокую степень устойчивости к грибковым патогенам и проявляющие себя как надёжные инсектициды, могут способствовать созданию трансгенных растений [12]. Также было показано негативное воздействие экзометаболитов Rana ridibunda на обработанное 0,1% раствором хлора зерно пшеницы [1]. Однако, после опытов с протравленным зерном, осталось не выясненным, как влияют экзаметаболиты этого вида амфибий на чистое зерно; и зависит ли это влияние, и как зависит, от физиологического состояния животного. Чтобы ответить на эти вопросы, было проведено два эксперимента.
Цель данной работы – экспериментальное исследование возможного влияния экзометаболитов озерной лягушки (в разных концентрациях) на темпы прорастания семян ячменя.
В задачи исследования входила оценка воздействия экзометаболитов на динамику формирования проростков и корней ячменя, а также определение степени влияния физиологического состояния амфибий на активность их экзометаболитов.
Материалы и методика
Было проведено два эксперимента. В первом эксперименте семь крупных озёрных лягушек 10 февраля 2013 г. были помещены в таз, с семью литрами водопроводной воды. Посуду поместили в помещение, с комнатной температурой и исключили попадание на животных прямого света от ламп. 17 февраля из ёмкости с амфибиями взяли литр жидкости, которую приняли за 100% раствор. Затем приготовили четыре раствора разной концентрации в следующей последовательности: контрольная группа; 1:100 (одна часть жидкости из ёмкости, где содержались амфибии на 100 частей водопроводной воды); 1:10; 1:1; 1:0,1; 1:0,01. Таким образом, в каждом из которых 100%-го раствора было на порядок ниже, чем в другом – от 10% до 0,01%. Для опыта использовано 300 зёрен ярового ячменя «Челябинск 99 (не очищен) урожая 2010 г. Кармаскалинский государственный сортовой участок, поле № 6». Зёрна разделили в равном количестве на 6 групп.
Каждую группу из 50 зёрен, в свою очередь, разделили на 5 подгрупп по 10 зёрен в каждой. Зёрна каждой подгруппы поместили в отдельную фильтровальную бумагу и, скрутив её в рулоны, поместили в шесть ванночек: 5 подгрупп одной группы в контрольную ёмкость с водопроводной водой, 5 подгрупп второй группы в ванночку со 100% раствором, 5 подгрупп третьей группы в ёмкость с 10% раствором, четвёртую группу в 1% раствор, пятую в 0,1% и шестую в 0,01% раствор. Измерения корневой системы растений и проростков проводились с 19 по 22 февраля 2013 г. Ежедневно, в течение четырех суток, отмечались сроки прорастания семян и число корней после их появления. Отдельно, штангенциркулем измерялась длина корней и проростков с точностью до 0,1 мм. Промеры осуществляли одни и те же люди. В ходе измерения оператором на компьютере отслеживался процент возможной ошибки, допущенной измерителем. И если таковое случалось, производились повторные промеры.
Второй эксперимент проводился с 23 марта этого же года. При его проведении были изменены условия содержания амфибий. Новую партию Rana ridibunda поставили на подоконник с южной стороны здания. С утра включали дополнительно искусственное освещение. Таз с амфибиями придвинули к тёплой батарее. Через два дня лягушки начали «петь». 30 марта была отобрана проба жидкости из ёмкости с амфибиями. Дальнейшая процедура полностью копировала условия первого эксперимента. Измерения проводили с 1 по 5 апреля 2013 г.
Результаты и их обсуждение
При проведении первого эксперимента выяснилось, что доля семян с проросшими корнями со вторых суток в контрольной группе была выше, чем во всех пробах, где присутствовали экзометаболиты озёрной лягушки (рис. 1).
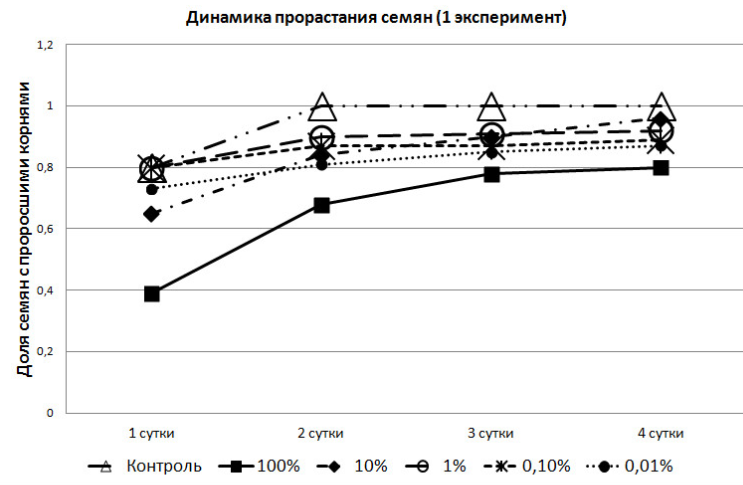
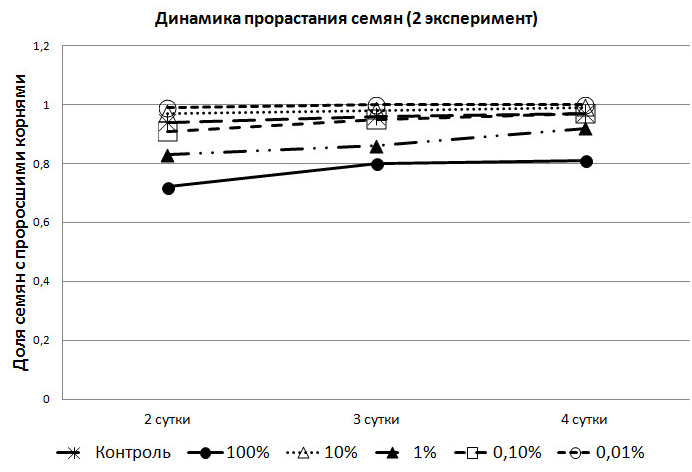
Рис. 1. Динамика прорастания семян в зависимости от концентрации метаболита
(I-й эксперимент).
Во втором же эксперименте, в опытных партиях доля семян с проросшими корнями была выше, чем в контрольной группе. Причём, в группе с 0,01% раствором, доля семян с корнями была ежедневно выше, чем в контрольной (рис. 2).
Рис. 2. Динамика прорастания семян в зависимости от концентрации метаболита
(II-й эксперимент).
Следует обратить внимание на то, что в феврале, семена, помещённые в 0,1% и 1% растворы, в первые сутки показали большую всхожесть, чем в контрольной группе. Но на вторые сутки в контрольной группе взошли уже все семена, в то время как в растворах проращивание семян закончилось; причём в 0,1% не взошло 10% семян, а в 1% растворе – 6%. В 100% растворе 20% семян не дали всходов и на четвёртые сутки.
Во втором эксперименте в растворах (кроме 1%), семена на второй день показали лучшую всхожесть, чем в первом. Семена, помещённые в раствор экзометаболитов с наиболее слабой концентрацией, показали лучшую всхожесть – на вторые сутки взошли все (рис. 2). Так же следует указать на разницу во всхожести между семенами, помещёнными в 1% и 10% растворы экзометаболитов. В феврале лидером по всхожести проявили себя семена ячменя в 1% растворе, а в апреле – в 10%. Следует отметить, что 1% раствор во втором эксперименте, хотя и незначительно, но показывал худшие результаты всхожести семян, чем в первом.
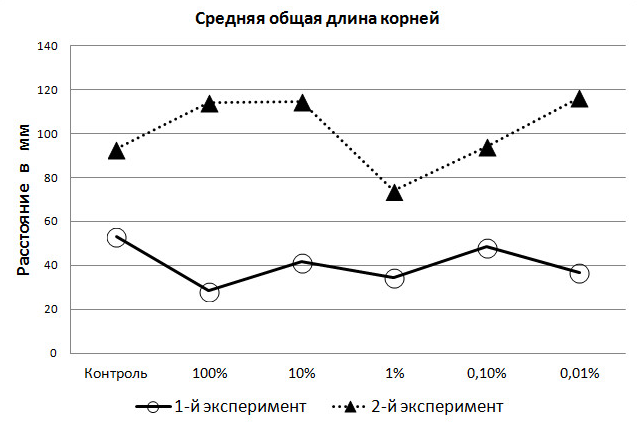
Результат измерения корневой системы проростков ячменя в первом эксперименте показал, что средняя общая длина корней в контрольной группе выше, чем в пяти опытных. Причём, наиболее близко к результатам контрольной группы были корни из 0,1% раствора, а наиболее отдалённые – из 100% (рис. 3). Внимание заслуживает то, что 1% раствор, в котором среди опытных групп в феврале взошло наибольшее число семян, по длине корней, выращиваемых в нём семян, на четвёртые сутки уже уступал всем, кроме 100%-го раствора. Это показывает избирательное действие находящихся в растворах активных веществ на рост и развитие разных органов растений.
Рис. 3. Средние значения длины корней проростков ячменя (мм) на 4-е сутки экспериментов.
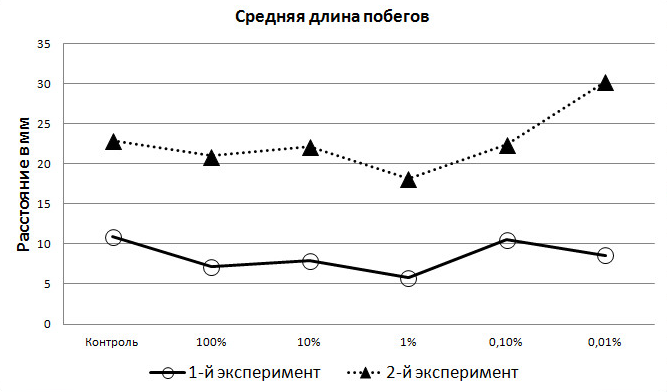
Измерения показали, что в стадии начала деятельного образа жизни амфибий экзометаболиты уже не угнетают, а, наоборот, стимулируют рост корней. Причём 100% раствор действует на этот процесс также положительно, как и другие, кроме 1% (рис. 4).
Рис. 4. Средние значения длины побегов (мм) на 4-е сутки экспериментов.
Однако и здесь проявляется стимулирующее действие экзометаболитов, т.к. величина роста корней проростков в первом эксперименте составляла 64,9% от измеренной величины контрольной группы, во втором – 79,5%; т.е. выше почти на 15% (P<00,5). Следует подчеркнуть и лимитирующую функцию 1%-го раствора на развитие длины корней.
Показано, что экзометаболиты в фазе «пробуждения» озёрной лягушки положительно влияют также и на рост побегов. Так, в первом эксперименте, когда амфибии находились в спокойном полусонном состоянии, величина длины побегов была высшей в контрольной группе и в 0,1% растворе (рис. 4).
В ходе второго эксперимента наблюдался рост побегов практически у всех растений 4-х опытных групп. Причём, у 3-х из них показатели роста были почти одинаковы в сравнении с контрольной группой. Величина побегов в 1% растворе, хотя и увеличилась на 26,3%, однако была наиболее низкой среди других групп (как и в первом эксперименте) (рис. 4). Данные, полученные нами в ходе второго эксперимента, вновь показали максимальное влияние на растения раствора с наименьшей концентрацией экзаметаболитов (0,01%), что намного превосходит аналогичные результаты в контрольной группе и по степени влияния других растворов. Следует отметить, что эффект влияния 0,1% раствора на побеги ячменя оказался таким же, как и в контрольной группе, что означает инертность такой концентрации по степени воздействия на рост и развитие растений. В то же время размер побегов в 100% и 10% растворах экзометаболита увеличился на 20-25% (рис. 4).
Сравнение величин роста корней и побегов показывает, что большие концентрации (100% и 10%) экзометаболитов амфибий сильнее влияют на длину корней, чем на длину побегов, в то время как наиболее слабый из растворов (0,01%) одинаково сильно влияет и на то, и на другое (рис. 4).
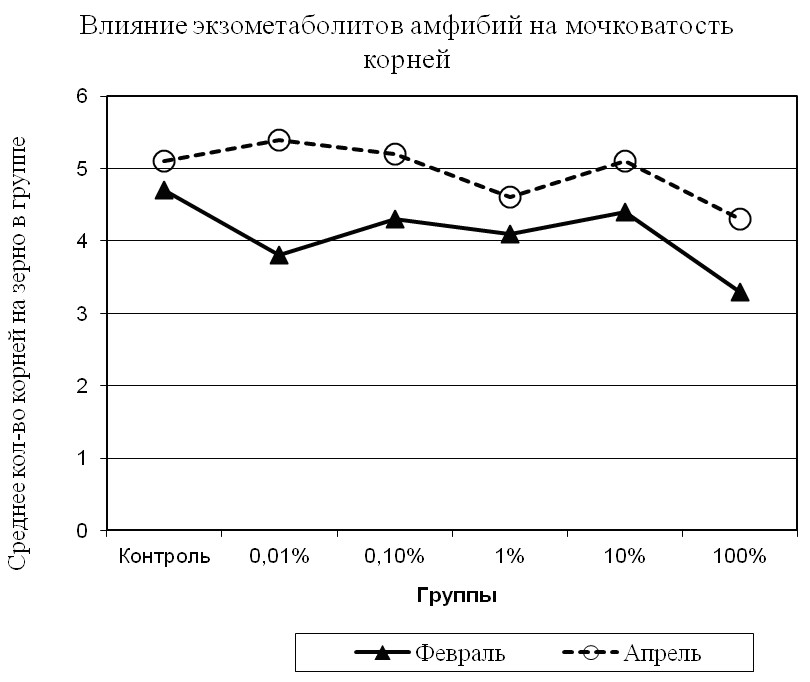
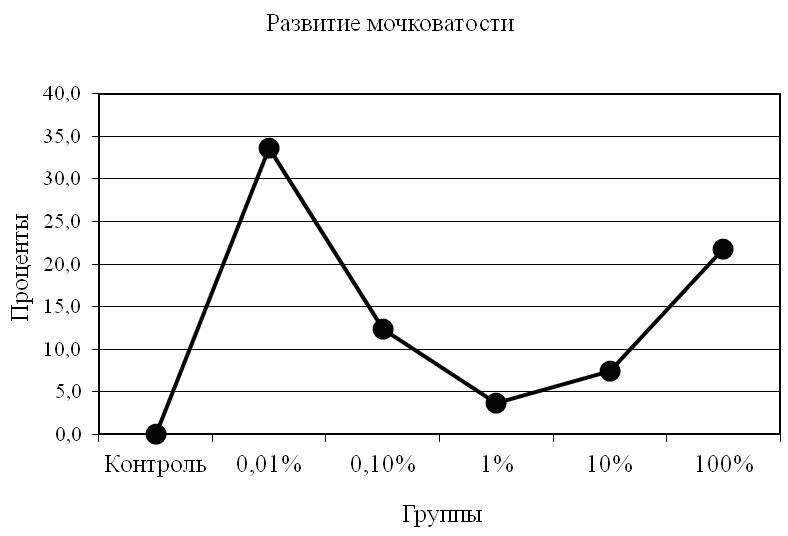
Изменение условий содержания амфибий во втором эксперименте повело за собой увеличение мочковатости корневой системы проростков ячменя (рис. 5).
Рис. 5. Среднее число корней на одно зерно (4 сутки).
Причём, среднее число корней на одно зерно в процентном отношении во втором эксперименте по сравнению с первым (кроме 1%) увеличивается значительно, особенно в 0,01% растворе (рис. 6).
Рис. 6. Увеличение мочковатости корней во втором эксперименте
по сравнению с первым; 4 сутки.
Сравнительный анализ результатов двух экспериментов по степени влияния экзометаболитов на проростки ячменя, показал в первом из них преобладание количества корней на одно зерно в контрольной группе (рис. 5) в сравнении со всеми опытными, что заметно уже было на вторые сутки. Во втором же эксперименте количество корней на зерно меньше, чем в контрольной группе, лишь в 1% и 100% растворах; т.е. 1% раствор опять показывает самую меньшую результативность (рис. 6). Иначе говоря, рост мочковатости корней в этом растворе лишь на несколько процентов превышает таковой в контрольной группе. Однако, судя по результатам второго эксперимента, показатель мочковатости корней в 0,01%-ном растворе экзометаболита превышает аналогичный показатель, полученный в первом эксперименте на 34%, а в 100%-м растворе – на 22% (P<00,5).
Данные исследований показывают, что при увеличении светового дня и температуры наступают явные перемены в качестве экзометаболитов озёрной лягушки. Это видно по развитию ячменя во всех опытных растворах. Следует указать, что наиболее активно экзометаболиты проявляются в очень слабых растворах – 0,1% и 0,001%. Результаты изучения влияния экзаметаболитов озёрной лягушки на развитие ячменя показывают отсутствие сходства воздействия одного и того же раствора на развитие разных его органов. Достоверно показано, что активизация половой деятельности амфибий стимулирует рост корней. Причём сильные растворы (100% и 10%), в этом случае, показывают такие же высокие результаты, как и наиболее слабый раствор (0,001%). Это указывает на возможность специфичного использования данных концентраций на повышение урожая; например, в засушливых регионах – путём увеличения корневой системы, а в слишком влажных – замедление её роста.
Кроме того, экспериментально доказана пассивность воздействия 0,1% раствора экзометаболитов на рост побегов ячменя и формирование мочковатости его корневой системы, В связи с этим можно полагать, что есть возможность управления ростом корней злаков с использованием растворов экзометаболитов.
Выводы:
Результаты экспериментов выявили избирательное воздействие различных концентраций растворов экзометаболитов озёрной лягушки Rana ridibunda на развитие проростков и корней ячменя.
Растворы экзометаболитов озёрной лягушки, полученные в фазе «покоя», способны сдерживать развитие ячменя: доля семян с проросшими корнями в контроле достоверно выше, чем в опытных партиях (p<0,01).
В фазе начала проявления активности этих земноводных, растворы экзометаболитов проявляют себя как биостимуляторы, начиная с концентрации 0,01% на проростки семян ячменя (p<0,05).
Величина концентрации растворов экзаметаболитов амфибий не коррелирует с уровнем воздействия на развитие ячменя.
1% раствор экзометаболитов сдерживает формирование корневой системы и рост побегов (p<0,05), не влияя, в то же время, на процесс развития мочковатости корней.