Романов В.В.
Канд. биол. наук, госпиталь птиц «Зеленый попугай», Московская обл., г. Балашиха, ш. Энтузиастов, 1; Ассоциация любителей птиц России.
E-mail: coelebs@yandex.ru
// Материалы по флоре и фауне Республики Башкортостан. 2014. № 5. С. 33-54.
Введение
Белый аист (Ciconia ciconia) – дальний мигрант, области зимовок которого располагаются от Сахары до Тайланда. Однако, некоторые молодые и взрослые особи в силу различных причин, так и не улетают, а остаются неопределенное время в местах гнездования. Поскольку аист относится к синантропным видам, ослабленные особи часто попадают в руки человеку и тогда люди сталкиваются с различными трудностями, связанными с оказанием помощи таким птицам. Случаи успешного содержания этих птиц в неволе нередки. Ослабленных аистов можно увидеть на домашних подворьях европейской части России, где они успешно живут среди домашней птицы. Основной рацион питания их в условиях неволи, как правило, состоит из рыбы и мяса. Причины ослабления белых аистов чаще всего связаны с различными заболеваниями, сходными с таковыми у других видов диких птиц. В этой связи назрела необходимость и в разработке адекватных методов их лечения. В данной статье описан опыт успешной реабилитации белых аистов.
Материалы и методы
На протяжении 2013 года в летне-осенний период в стационар госпиталя птиц «Зеленый попугай» поступали аисты с различной степенью ослабленности, связанной как с травмами, различными нарушениями обменного характера, так и инфекционными и инвазионными заболеваниями. Птицы помещались в реанимационное помещение, где у них производили забор анализов для лабораторной диагностики методами ПЦР, на общую микробиологию, ИФА. Проводили биохимические исследования крови на автоматическом анализаторе. Также проводилась инструментальная диагностика при помощи рентгеновского аппарата и ультразвукового сканера фирмы Sonoage. Все исследования белых аистов Сiconia ciconia проводились на оборудовании госпиталя птиц «Зеленый попугай» без привлечения сторонних лабораторий.
Назначение антибактериальных средств проводилось в строгом соответствии с данными микробиологических исследований и определением чувствительности к антибиотикам выявленных патогенных микроорганизмов. После клинического выздоровления аисты переводились в вольеры реабилитационного центра «Птицы без границ» им. А.И. Куинджи, где птицы проходили курс восстановительной реабилитации. Травмированным птицам в области трубчатых костей конечностей проводилась иммобилизация методами, адаптированными к хирургии птиц, по сути являющимися в ряде случаев реконструктивными методами лечения. Использовались металлоконструкции (спицы, пластинки и шурупы) по стандартным ветеринарным методикам. Применяли созданный на базе госпиталя птиц Зеленый попугай аппарат «Лавром». Использовали инъекционную и газовую анестезию.
Последующее лечение и восстановление птиц проводилось в брудерах госпиталя птиц, а затем, по мере клинического выздоровления, животные перемещались в закрытые вольеры больничного отделения госпиталя. После реабилитации группу белых аистов из семи птиц поместили в открытые вольеры. Вольеры при этом открывались настежь для того, чтобы птицы могли перемещаться свободно по территории реабилитационного центра и прилегающей территории, а в случае необходимости возвращаться обратно.
Во время свободных перемещений птиц продолжали докармливать в открытых вольерах.
Исследования болезней аистов Ciconia ciconia
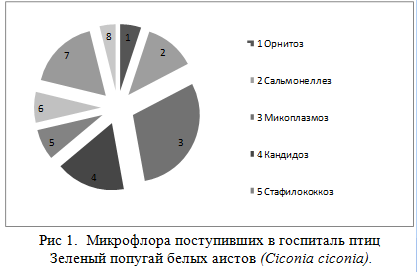
Полученные нами данные совпадают с независимыми данными и выводами, полученными в результате исследований, проведенных на дальневосточном аисте (Ciconia boyciana), обитающем в естественных природных условиях на территории Амурского и Нанайского районов Средне-Амурской низменности и содержавшихся в вольерных условиях. Результаты этих исследований приведены в таблице 1 и на рис. 1.
Таблица 1.
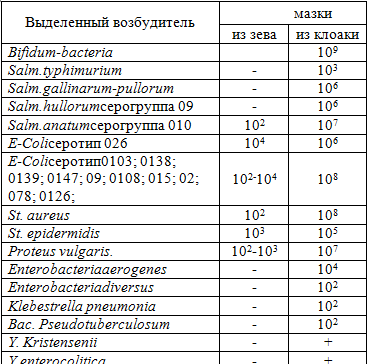
Бактериальная микрофлора аистов.
У дальневосточного аиста (Ciconia boyciana) отмечены колебания показателей микробиоты кишечника птиц в природе в разные годы без внешних изменений состояния здоровья обследуемой особи. При этом высокий уровень воды в гнездовой период 2004 года и затяжная холодная весна 2006 характеризовались повышением количества сальмонелл и патогенных штаммов кишечной палочки с проявлением клинических признаков заболевания у птенцов. В микрофлоре дальневосточного аиста (Ciconia boyciana) в условиях вольерного содержания наблюдалось изменение количественного и качественного состава. В частности, появлялись условно патогенные формы бактерий – Candida, Klebiellapneumoniae, Edardsiellahoshinae, Serratiamarcescens, Bordetella, Moraxella.
У белого аиста (Ciconia ciconia) нами были выделены те же возбудители инфекционных заболеваний, что и у дальневосточного аиста, но кроме этого было обнаружено несколько новых возбудителей.
Микоплазмоз
Микоплазмоз Mycoplasma является наиболее распространенной инфекцией и выявлялся у всех поступивших белых аистов. Согласно нашим исследованиям носителями микоплазмоза являются: около 60 % диких воробьиных птиц Passeriformes, в частности, зяблики, славки, дрозды, скворцы; 65% Galiformes – рябчики и куропатки; 30% свободно живущих охотничьих фазанов в Окском заповеднике; среди врановых Москвы и Санкт-Петербурга около 50% серых ворон, 44% грачей, 17% галок. Отмечены случаи заражения микоплазмозом и среди куликов. Довольно часто встречается микоплазмоз среди птиц отряда Попугаев Psittaciformes, в частности, среди жако, какаду, ар, волнистых попугайчиков, корелл или нимф, неразлучников; отмечается также среди голубей и сельскохозяйственной птицы. Однако, ни у одного вида эта инфекция не была распространена так сильно, как у обследованных нами белых аистов (100% результат). Вероятно, сыграло роль то обстоятельство, что анализы брали от птиц, зимовавших в одном помещении. Тут следует обратить внимание на патогенез микоплазмы у декоративной и сельскохозяйственной птицы. В случае носительства микоплазмы, если не присоединяется вторичная инфекция или инвазия или какие-либо функциональные нарушения работы паренхиматозных органов, инфекция находится в латентной форме и не влияет на клиническое состояние птицы. В случае проявления клинических симптомов у домашней птицы это заболевание проявляется в респираторной форме, в синовитах, артрозах, в падении яйценоскости у кур несушек. Казалось бы, очевидным фактом является слабая патогенность или даже отсутствие патогенности микоплазмы для ее носителей среди диких птиц. Однако, это ложное представление обусловлено на наш взгляд тем, что в природных условиях у диких птиц иной микробный пейзаж по сравнению с птицами содержащимися в неволе, где изменение микрофлоры кишечника в первую очередь проявляется в виде количественного соотношения определенных видов микробов компенсируемого за счет условно-патогенной микрофлоры, более характерной для вольер, квартир и прочих помещений. Таким образом, микоплазмоз, который регистрируется равно как у домашних, так и у диких птиц переходит из латентной формы в хроническую и даже порой в довольно агрессивную форму заболевания, проявляющуюся в клинических признаках. В птицеводстве обычно применяют макролиды и плевромутилины (тиамулин, родотиум), тилозин (фармазин),тилмикозин (тилмовет), которые, впрочем, не могут элиминировать возбудитель из стада. При лечении аистов нами был применен иной подход. С целью нормализации микробного пейзажа желудочно-кишечного тракта птиц мы применяли такие пробиотики, как ветом 1-1, лактобифидобактерии, витаминные препараты и препарат, стимулирующий антиинфекционный иммунитет птиц – иммуним.
Кандидоз
Следующим по частоте встречаемости среди бактериальных инфекций у аистов оказался кандидоз – 57,14%. Во время исследований, проведенных нами в 2008 году на декоративных птицах, мы обнаружили этот грибок у 45,48% особей. Микробиологические анализы были взяты у птиц с выраженными клиническими признаками заболевания. К клиническим признакам кандидомикоза относятся такие симптомы, как срыгивание корма, утолщение стенок зоба, воспаление зоба, коньюктивиты, вялость, диарея, дегидратация, кахексия, бронхопневмонии, нарушение пигментации пера, алопеции, трихоптиломания, дерматиты. Во время исследований, проведенных на диких птицах, Candida albicans обнаружен не был. В частности, при исследованиях различных видов воробьиных птиц (зимородков, овсянок, зябликов, мухоловок, каменок, скворцов, дроздов, стрижей и др.) на территории, непосредственно примыкающей к Окскому Биосферному заповеднику, кандидамикоза обнаружено не было, зато были выявлены другие микроорганизмы: Botricis , Aspergellusniger, Pennicilium, Echerihiacoli, Proteusvulgaris, Coccus.
По некоторым данным, кандидамикоз – это микотическое заболевание, затрагивающее верхние участки пищеварительного тракта. Однако, по нашим данным у попугаеобразных птиц (жако, ар, какаду, какариков, ожереловых и других кольчатых попугаев, волнистых попугаев, корелл или нимф, неразлучников) и голубей возможны и такие проявления, как бронхопневмонии, дерматиты, нарушение перообразования и самоощипывание птиц. Кандидомикоз часто входит в состав патогенных микробных ассоциаций, что утяжеляет течение болезни. Наряду с присутствием явных клинических признаков, отмечается и бессимптомное носительство. Следует отметить, что в норме кандидамикоз не обнаруживается на слизистой пищеварительного тракта, так как нормальная микрофлора птиц, очевидно, подавляет рост этого грибка, но при нарушении микрофлоры данный грибок появляется у птиц. Это и является предвестником функциональных нарушений желудочно-кишечного тракта птицы. Патологоанатомические изменения павших птиц, в общем, затрагивают в первую очередь пищеварительный тракт. Отмечаются наложения беловатые, беловато-желтые, желтоватые или коричневатые на слизистых оболочках ротоглотки, пищевода (более интенсивные наложения по вершинам складок). Наложения часто плотно срастаются со слизистой (особенно сильно поражается слизистая зоба) – это связано с тем, что гифы грибка проникают в глубину эпителия и иногда достигают подслизистой ткани. Несмотря на то, что обследуемые белые аисты были взяты из дикой природы, у них обнаружено большое количество этого грибка. Видимо, сыграло роль то обстоятельство, что до забора анализов птицы провели некоторое время в условиях неволи у разных людей до того, как попали к нам в руки. Следует отметить, что явных клинических симптомов кандидамикоза у аистов, как и у других экзотических и домашних птиц, нами обнаружено не было.
Сальмонеллез
У аистов высокий показатель носительства обнаружен для Salmonella spp. – около 43%. Сальмонеллез – это одно из самых агрессивных заболеваний у птиц, содержащихся в неволе. Клинические признаки этой инфекции обнаруживались нами в первую очередь у птиц, которые при содержании их в неволе имели возможность выхода на волю. Так мы отмечали сальмонеллу у различных пород голубей: голубей-статных, голубей–гривунов, почтарей, гонных. Отмечается эта инфекция и у хищных птиц, используемых в качестве ловчих, а именно, у тетеревятников, перепелятников, сапсанов, балобанов, беркутов. Также мы обнаруживали сальмонеллез и среди птиц зоопарков. Среди синантропных видов диких птиц отмечена сальмонелла у сизых голубей, серых ворон, грачей и воронов. Среди домашних птиц обнаруживали сальменеллу у различных видов попугаев: краснохвостых жако, малого желтохохлого какаду, волнистых попугаев, корелл, различных видов неразлучников, ары сине-желтых и зеленокрылых, и венесуэльских амазонов. Сальмонеллез не был отмечен в журавлином питомнике Окского биосферного заповедника во время диспансеризации в период с 1998 по 2003 год. В то же время, среди содержащихся в неволе журавлей были обнаружены другие 18 видов микробиологической флоры. При сравнении инфекционного фона среди диких птиц в том же районе Окского Биосферного заповедника оказалось, что одним из резервуаров Salmonella spp. является природная популяция местных зимородков Alcedo atthis. При обследовании воробьиных птиц неподалеку от журавлиного питомника сальмонеллеза не обнаружили.
При обследовании природной популяции белоплечего орлана Haliaeetus pelagicus Pal. на Северном Сахалине у птенцов, как правило, сальмонеллеза не обнаруживали. Однако было установлено, что в качестве одной из причин развития инфекционного перикардита с последующей гибелью одного из птенцов орлана явилась Salmonella Minneapolis.
Обнаруживали сальмонеллу у кудрявых пеликанов, попавших в зону природной экологической катастрофы, с проявлением клинических симптомов пикацизма на фоне вульгарного истощения из-за отсутствия кормовых ресурсов около г. Махачкалы республики Дагестан. Сальмонелла является весьма обычным явлением у поступающих в реабилитационный центр чаек – серебристых, сизых, озерных, клуш, бургомистров. Тут следует отметить, что безусловными патогенными штаммами, вызывающими клинические признаки заболевания являются Salmonella typhimurium и Salmonella Minneapolis. В то же время, иные штаммы сальмонеллы, обнаруженные нами среди диких околоводных видов птиц, включая и белых аистов, не являются патогенными.
Пастереллез
Pasteurella multocida является патогенным микроорганизмом для птиц. В настоящее время различают несколько подвидов бактерии P.multocida и 16 различных серотипов. Серотипы диких видов птиц часто отличаются от серотипов сельскохозяйственной птицы. В частности, пастереллез нами был обнаружен среди вольерной популяции журавлей Окского Биосферного заповедника – у одного из японских журавлей. В данном случае болезнь протекала с клиническими признаками инфекционного артрита.
Также пастереллез проявляется у экзотических и домашних птиц подворья в виде различных заболеваний респираторной системы, интоксикации, диареи, а также в виде локальных воспалительных процессов. Носительство пастереллы у аистов втречалось у 23 % особей. Следует, однако, учесть, что бактериологические исследования нами проводились уже после того, как птицы некоторое время содержались в неволе, при этом нередко белых аистов содержали вместе с сельскохозяйственной птицей.
Стаффилококкоз
Уровень носительства пастереллы у белых аистов оказался на таком же уровне, как и носительство стафилококка Staphylococcus. Однако среди носителей стафилококковой инфекции как моно, так смешанной, в госпиталь птиц «Зеленый попугай» в период исследования поступали и другие виды птиц: волнистый попугай Melopsittacus undulatus, корелла Nymphicus hollandicus, неразлучник Фишера Agapornis fischeri, масковый неразлучник Agapornisper sonata, розовощекий неразлучник Agapornis roseicollis, ожереловый попугай Psittacula krameri, краснохвостый и бурохвостый жако Psittacus erithacus, какаду желтохохлый Plyctolophus galeritus , эклектус, розелла Platycercus elegans, кубинский амазон Amazona leucocephala, венесуэльский амазон Amazona amazonica, синелобый амазон Amazona aestiva, какарик Cyanoramphus novaezelandiae, синежелтый ара Ara ararauna, зеленокрылый ара Ara chloroptera, зебровая амадина Taeniopygia guttata, амадина Гульда Chloebia gouldiae, щегол Carduelis carduelis, зяблик Fringilla сoelebs, кенар, серая ворона Corvus cornix, ворон Corvus corax, стриж Apus apus, сизый голубь Columba livia, бойный голубь, почтовый голубь, лебедь- шипун Cygnus olor, индоутки, белолобый гусь Anser albifrons, перепел, павлин, курица, петух кахенхин, индюк, сизая чайка Larus canus, пеликан Pelicanus crispus, ястреб тетеревятник Accipiter gentilis, сапсан Falco peregrinus, балобан Falco cherrug, обыкновенный канюк Buteo buteo.
Обнаружилось сходство патофизиологических изменений при ассоциации стафилококка с другими инфекциями или инвазиями с симптомами, проявляющимися при стафилококковой моноинфекции, которая в данном случае выступает как суперинфекция.
В отличие от данных других авторов, настаивающих на преимущественном преобладании при стафилококке патологических изменений в костях, влагалищах сухожилий, суставов конечностей и значительно реже, септицемией (в жаркое время) кожи, сердца, желточного мешка, суставов грудной клетки, позвонков, век, гранулемы в печени и легких, по нашим данным, стафилококковая инфекция сопровождает следующие клинические заболевания, расположенные нами в порядке клинической значимости сверху вниз: бронхопневмония, воспаление зоба, кахексия, коньюктивит, диарея, воспаление желудочно-кишечного тракта, трихоптиломания, патологическая линька, дерматит, нефрит, гепатит, интоксикация, травма, ринит, гипотермия.
Орнитоз
Только у одного из белых аистов мы обнаружили орнитоз. В данном случае речь идет о явной передаче Chlamydia psittaci от других птиц. Данная особь до поступления в госпиталь содержалась с домашней птицей в приусадебном хозяйстве, т.е. птица была взята не непосредственно из природы. Кроме того, домашняя птица здесь не была изолирована от контакта с дикими голубями.
Орнитоз является, безусловно, патогенным микроорганизмом, поэтому мы особенно внимательно относимся к каждому случаю обнаружения этой инфекции.
Заражение орнитозом в г. Москве по нашим данным за период с сентября по декабрь 2005 года (на основании результатов, полученных в лаборатории молекулярной диагностики ВГНКИ) составило: у голубей – 42,8%, у попугаев – 8,1 % . При этом, как правило, голубей собирали на территории города, – птицы находились в тяжелом состоянии. Попугаев тестировали на орнитоз или непосредственно после приобретения, или по прошествии некоторого времени жизни у владельцев (при ярко выраженных клинических признаках). В основном у вновь приобретенных декоративных птиц орнитоз не обнаруживался. Среди попугаев, особенно подверженных заболеванию орнитозом оказались неразлучники Agapornis roseicollis и кореллы Nymphicus hollandicus.
Криптоспоридиоз
Криптоспоридиоз относится к паразитарным оппортунистическим заболеваниям, которые поражают не только птиц, рептилий и рыб, но и млекопитающих, в том числе и человека. По представлениям до 2000 года криптоспоридиоз относился к паразитическим простейшим из рода Cryptosporidium, семейства Cryptosporidiidae, отряда Coccidiida, класса Coccidea, типа Sporozoa. Однако, после 2000 года, благодаря молекулярным и физиологическим исследованиям оказалось, что данные паразиты ближе к грегаринам. Поэтому гипотетическое филогенетическое древо расположения различных групп внутри Apicomplexa имеет несколько иной вид, и криптоспоридий уже не относят к кокцидиям. Криптоспоридии при паразитировании не проникают внутрь клеток, как кокцидии, а используют своеобразную симбиотическую связь с клетками слизистой кишечника. Жизненный цикл паразита проходит в одном хозяине (гомоксенный паразит) и занимает от 4 до 7 дней. При криптоспоридиозе работает гуморальный и клеточный иммунитет инфицированной птицы. Инвазионные ооцисты от белого аиста (рис. 1) выделяются во внешнюю среду, в это время их можно увидеть в нативном мазке, сделанном со слизистой клоаки. При световом микроскопировании с объективом х40 в ооцисте можно увидеть поперечные включения, которые являются свободно лежащими 4-мя вытянутыми спорозоитами. В это же время сами ооцисты округлой формы. Путь заражения других птиц происходит прямой передачей через корм и другие носители инвазионных ооцист. После того как ооцисты попадают в кишечник, их оболочка разрушается и освобожденные продольные спорозоиты внедряются между ворсинками эпителия. И тут начинает проявляться основное свойство криптоспоридий, доказывающее их родственное отношение к грегаринам, а именно, спорозоиты не проникают в цитоплазму клеток эпителия, а прикрепляются на поверхности щеточной каймы микроворсинок эпителия, склеиваются, склеиваются и микроворсинки между собой и тем самым ограничивают спорозоит от полости кишечника. Возникает сложный патофизиологический процесс, при котором соседние микроворсинки атрофируются, и образуется складчатое образование – питающая органелла. Так, в итоге, возникает паразитоформная вакуоль с питающей паразита органеллой. Такие вакуоли возникают уже через 24 часа после попадания в просвет кишечника инвазионных ооцист. В паразитоформной вакуоли на следующем этапе возникает шизогония трофозоитов (бесполое множественное деление), во время которого, в течение 72 часов формируются многочисленные шизонты, мигрирующие на соседние щеточные каймы ворсинок эпителия кишечника. После второй регенерации шизонтов на следующей стадии начинается половой процесс (гаметогония), во время которого формируются микрогаметы (мужские половые клетки) и макрогаметы (женские половые клетки), после их слияния в районе щеточной каймы образуется зигота, которая выпадает затем в просвет кишечника и покрывается оболочкой. После ее спорулирования и формирования 4-х спорозоитов она становится инвазионной. Ооцисты с тонкой облолочкой (около 20%) остаются в кишечнике и реинвазируют птицу, обеспечивая тем самым аутоинвазию, а остальные – с более толстой оболочкой (около 80%) выделяются во внешнюю среду, обеспечивая глобальное распространение паразита.
Криптоспоридиоз среди птиц отмечался у таких сельскохозяйственных птиц, как куры, индейки, перепела, домашние утки. Также эти паразиты, в частности Cryptosporidum muris встречаются у лабораторных мышей и морских свинок. У кур и уток обнаружены два вида этого паразита, а именно, Cryptosporidum baileyi и Cryptosporidum meleagridis. При этом, Cryptosporidum baileyi является тропным к таким органам, как клоака и фабрициева сумка, а также к респираторной системе кур и индеек, а Cryptosporidum meleagridis тропен к тонкому кишечнику. Возможно, благодаря мышам и крысам, которые являются бессимптомными носителями криптоспоридиоза, данное заболевание широко распространено на животноводческих и птицеводческих фермах. Так в европейских странах заболеваемость телят этой болезнью колеблется от 22 до 40% от числа заболевших, у которых наблюдались признаки диареи. Также заболевает молодняк таких сельскохозяйственных животных, как овцы и козы [3]. Всего в настоящее время выделяют 23 вида криптоспоридий, однако эти виды не являются строго специфичными, и пока их количество является предметом споров паразитологов.
Если у птиц при этом заболевании проявляются такие клинические признаки как диарея, сильный неприятный запах фекалий, а также легочная недостаточность различной степени, то у змей и других рептилий, наиболее ярким клиническим проявлением при хронических инфекциях является отек желудка, визуализируемый в конечной стадии из-за сильно увеличенного живота и возможного наличия венозного застоя поверхностных вен. То, что у птиц обнаружены такие виды криптоспоридий, как Cryptosporidum baileyi и Cryptosporidum meleagridis не обозначает, что они не заражаются другими видами этих паразитов. Пока этот вопрос в мире остается открытым, так как, эти виды не являются строго специфичными и, к тому же, еще не налажена точная диагностика большинства видов криптоспоридиоза. Те криптоспоридии, которые выделили у людей и назвали Cryptosporidum parvum, вызвали эпидемию в Милуоки, поразившую в 1993 году порядка 403000 человек. Вспышка заболевания была вызвана употреблением зараженной воды. Заражение произошло через испражнения крупного рогатого скота, которые попали в воду. Из-за их повсеместного распространения, криптоспоридии можно найти в почве, еде, воде и на любых поверхностях, загрязненных калом инфицированных людей и животных, например, через трансмиссивную передачу при помощи мух. У людей клинические признаки целиком зависят от состояния иммунитета, который часто определяется возрастом контаминированного индивидуума. Так, здоровые люди часто страдают в течение 1-2 недели водянистой диареей, в то время как люди имеющие проблемы со здоровьем, вследствие заражения могут приобрести хронические трудно искоренимые симптомы заболевания.
У белых аистов клинические симптомы заболевания криптоспоридиозом, наблюдавшиеся в госпитале птиц, не имели сколько-нибудь ярко выраженных патогномичных симптомов, только проявление общей слабости, отсутствие способности к полету на фоне недостаточной легочной компенсации. Как правило, такая птица не истощена и находится в удовлетворительном состоянии. Отмечено, однако, что больная птица занимает более низкую иерархическую ступень в группе аистов.
В биохимии крови отмечается повышение уровня триглицеридов, и белка в сыворотке.
Рис. 1. Ооцисты криптоспоридий, выделенные со слизистой
клоаки белых аистов.
Болезни обмена веществ
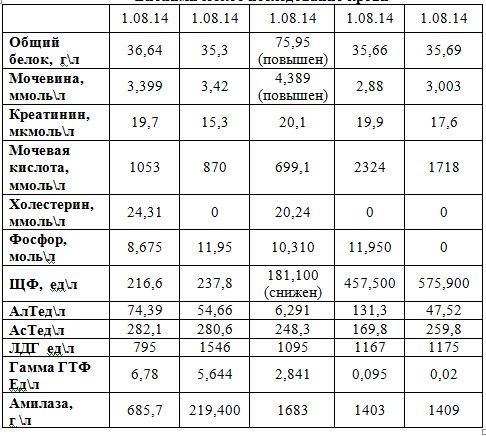
Одним из точных методов для определения физиологического состояния аистов и оценки обмена веществ, безусловно, являются биохимические тесты. Ниже мы приводим данные исследований (Табл. 1 и рис.2), которые могут помочь выделить из группы аистов больную особь, страдающую заболеваниями почек и печени с тем, чтобы провести соответствующее лечение.
Нарушения обмена веществ у белых аистов и возникновение физиологических аномалий чаще всего случается во время гнездового периода. У аистов, попавших в руки человека именно это и является основной этиотропной причиной физиологического ослабления организма птиц с последующим наложением секундарных инфекций (см. выше). Не последнюю роль играет травматизм. По данным госпиталя птиц «Зеленый попугай» (по результатам обработки 1345 больничных листов) к наиболее часто встречающимся заболеваниям декоративных птиц относятся нарушения обмена веществ. Они составляют более 17% всех патологий птиц. Во многих случаях причиной является неправильное содержание и кормление.
Таблица 2.
Биохимическое исследование крови
 У белых аистов такие нарушения связаны, в частности, с неодновременным вылуплением птенцов и, как следствие, неизбежным ослаблением младших птенцов. Эти птенцы становятся своеобразными физиологическими «инвалидами».
У белых аистов такие нарушения связаны, в частности, с неодновременным вылуплением птенцов и, как следствие, неизбежным ослаблением младших птенцов. Эти птенцы становятся своеобразными физиологическими «инвалидами».
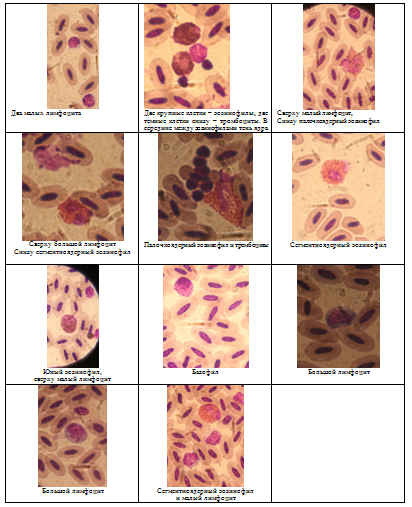
Рис. 2. Морфология клеток крови.
Нарушения обмена веществ, связанные с алиментарными причинами могут проявляться по-разному. Например, недостаток Са у некоторых молодых аистов проявляется в размягчении костей – рахите (трубчатые кости у таких птиц буквально гнутся при нажиме), изменении конфигурации костей. Переломы костей часто приводят к болевому шоку у птиц. Похожие явления мы наблюдали у молодых журавлей в питомнике Окского Биосферного заповедника.
В сравнении со взрослыми экзотическими птицами (например, серыми попугаями или амазонами), на фоне снижения уровня кальция в сыворотке крови отмечается изменение или нарушение перообразования (аптериозы), а также тонико-клонические судороги без диагностируемых патологий со стороны костной системы. При этом регистрируется снижение уровня кальция при биохимическом анализе сыворотки крови. К нарушениям обмена веществ у аистов, можно отнести гиповитаминозы, к которым приводят недостаточность или несбалансированность минеральных веществ, сниженное потребление белка и др.
Таким образом, большая часть патологий у слетков белого аиста, связанна с нарушением обмена веществ из-за неправильного, несбалансированного питания и недоедания. На фоне общей дистрофии возникают расстройства пищеварения, развиваются пододерматиты, конъюнктивиты, хронические болезни легких, воспаления слизистых, различные нефропатии, возникают застойные явления в гепатобилиарной системе птиц.
Гипотермия аистов
Часть аистов поступала в госпиталь птиц с пониженной температурой тела в слабой и средней степени – 38,9 – 39,5º С. Гипотермия возникала у птиц как следствие простудных заболеваний, ослабления иммунитета (ослабляется фагоцитоз и выработка антител). Эти причины способствовали изменению микробного пейзажа птиц и даже сдвигу формулы микробов в сторону патогенных микроорганизмов. Все это в совокупности провоцировало возникновение воспалений легких, почек, желудочно-кишечного тракта. Также гипотермию провоцируют такие болезни как сердечная недостаточность, гипотиреоз, голодание, легочная инфекция, сепсис, мозговые травмы и любые заболевания, приводящие к иммобилизации птицы. Аистам в состоянии гипотермии применяли прогревание нейтральным теплом, получаемым в камере брудера, проводили ингаляцию теплым влажным воздухом, осуществляли подачу кислорода в брудер. В период согревания возможно развитие ацидоза, поэтому каждые 1,5 – 2 часа во время восстановления температуры тела мы вводили препарат темперин (состав препарата расшифрован ниже), который способствует также и подъему температуры тела. В фармакологии существует понятие терапевтической широты – это применяемые терапевтические дозы лекарственных веществ от минимальной до максимальной. В практике врача чрезвычайно важно подобрать оптимальные дозы лекарственного вещества, обеспечивающие высокий терапевтический эффект без существенных побочных эффектов. Минимальные дозы, вызывающие слабовыраженные фармакодинамические и фармакотерапевтические эффекты, назначаются при тяжелом течении болезни и пониженном жизненном уровне. Максимальные, которые наряду с выраженным терапевтическим эффектом вызывают появление негативных изменений из-за токсического действия лекарственного вещества, назначаются при недостаточно выраженном терапевтическом эффекте от введения оптимальных доз. В практике врача бывают случаи введения лекарств в дозах, укладывающихся в терапевтическую широту, вызывающие при этом необратимые изменения, и даже при применении соответствующих антидототерапевтических мер животное гибнет. Расчёт оптимальной дозы лекарственного вещества производится с учетом вида, породы, пола, возраста, физиологического состояния. Чем выше интенсивность метаболизма данного вида (породы) животного, тем в больших дозах на 1 кг веса и частоте кратности введения лекарств требует организм пациента. У молодых животных дозы повышаются на 20-30%, у самцов на 10-20% выше, чем у самок. Имеет значение и тип поведения – у животных с холерическим и сангвиническим типом поведения (сильные типы высшей нервной деятельности) реактивность выше, чем у животных с третьим и четвертым типом поведения по Павлову. Дозы, таким образом, будут различаться на 10-15% для слабого и сильного типа соответственно.
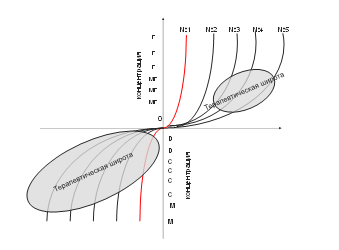
Рис.3. Зависимость терапевтической широты воздействия традиционных и гомеопатических лекарственных средств от концентрации действующего вещества и разведения (гомеопат.) соответственно.
В то же время гомеопатическое лекарствоведение позволяет выйти за рамки минимальных традиционных доз посредством применения последовательного разведения лекарственного вещества, тем самым увеличивая возможности при лечении гипотермий у птиц, не вызывая при этом побочных эффектов, как при применении традиционных лекарств. Все сказанное как нельзя лучше иллюстрирует график (рис.3), отражающий наиболее характерные показатели физиологического состояния птиц при применении терапевтических доз препаратов, применяемых в традиционной медицине и гомеопатии. В соответствии с ним мы и использовали препараты для лечения гипотермий.
Линии № 1, № 2, № 3, № 4, № 5 – физиологическое состояние птиц (от худшего – №1 до хорошего – № 5).
Правая верхняя часть графика показывает дозы традиционных средств, применяемых в лечении птиц, а левая нижняя часть представляет собой концентрации гомеопатических лекарственных средств по гомеопатической классификации (D – десятичные разведения, С – сотенные разведения, М – миллионные разведения). Оценку состояния птиц осуществляли при помощи общепринятых в ветеринарии методов: визуализации, пальпации, аускультации и термометрии. Окружности, пересекающие линии физиологического состояния птиц, являются терапевтической широтой как аллопатических, так и гомеопатических средств. Высокие потенции гомеопатических средств также могут привести животное, находящееся в состоянии № 1 и № 2, к гибели. Поэтому нами была построена окружность терапевтической широты и для гомеопатического препарата.
В госпиталь птиц «Зеленый попугай» из 100 % поступивших птиц, около 10 % страдают гипотермией в той или иной степени. Кроме того, гипотермия у птиц возникает после применения наркоза при проведении хирургических операций. У птиц можно различить 3 степени гипотермий, с учетом их изначально высокой температуры тела – от 40–44 Сº. Температура тела у птиц измеряется ректально. Слабая степень гипотермии находится в пределах 39–40 Сº, промежуточная степень 36–39 Сº и глубокая степень ниже 36 Сº. Поэтому наряду с помещением птиц в зону нейтрального теплового окружения, создаваемого посредством брудера, перорально (в клюв) птицам вводится гомеопатический препарат, содержащий Gelseminum, Calcareacarbonica, Acidumphosphorica , Ferrumphosphorica, Gentiana. Нужно обратить внимание, что данный препарат также помогает и при судорогах птиц без симптома гипотермии. Поэтому тот же препарат нами применяется при характерных систематических обморочных состояниях птиц с явлениями параличей и параплегий.
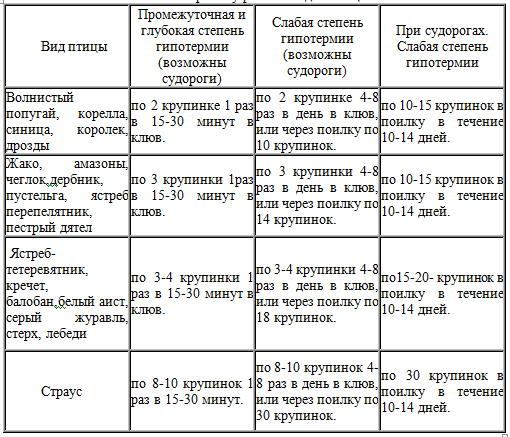
Порядок употребления гомеопатических средств при различных степенях гипотермии у разных видов птиц. Указанные препараты мы получаем по стандартной гомеопатической методике. Производится равномерное уменьшение концентрации путем многократного последовательного разведения (или растирания) в нейтральном растворителе (этиловый спирт) и многократного вертикального встряхивания каждого полученного разведения с использованием отдельных емкостей для каждого последующего разведения до получения требуемой дозы (потенции) из исходного сырья: Gelseminum – Желтый жасмин (эссенция из свежего корня); Calcarea carbonica – Средний слой устричных раковин; Acidum phosphoric – Фосфорная кислота; Ferrum phosphoric – Железо фосфорнокислое, Gentiana – Горечавка (эссенция из свежего корня). Вспомогательные вещества: (сахарная крупка по ГОСТ 7060-79) до 100 г.
Таблица 3.
Порядок употребления гомеопатических средств при различны степенях гипотермии у разных видов птиц
Травматология
Основной причиной травматизма у взрослых белых аистов являются электрические повреждения, получаемые птицами на линиях электропередач. При сильном электрическом поражении птицы погибают, а некоторые при этом страдают параличом задних конечностей. При механической травме, полученной на линиях электропередач, страдают конечности птицы. При этом возможны как переломы, так и повреждение мягких тканей, например, Plica alarm, вследствие которых птица теряет способность к полету. Также большой процент слетков аистов получают травмы во время первых тренировочных полетов.
Еще одной причиной получения травм птицами является выпадение из гнезд молодых аистов в возрасте, когда у тех еще не достаточно сформированы перья для того, чтобы поддерживать птенца в воздухе. Выпадение младших птенцов происходит вследствие прессинга со стороны старших птенцов, избавляющихся таким образом от пищевых конкурентов. Вследствие удара о землю, у таких птиц часто возникают различные переломы трубчатых костей, которые даже при адекватном лечении, по причине дистрофии приобретенной еще в гнезде (из-за упомянутой выше конкуренции между птенцами), лечатся тяжелее, чем аналогичные травмы у молодых аистов, находящихся в хорошем физическом состоянии. Поэтому, кроме хирургического лечения необходимо применять терапию, направленную на устранение дистрофии птиц. Первый вопрос, который стоит перед специалистом, это восстановление целостности костной системы. Здесь трудно обойтись без применения металлоконструкций. В качестве фиксирующего материала применяются спицы, пластинки, шурупы. Дополнительно к металлоконструкциям, применяемым при интермедуллярном и экстрамедуллярном остеосинтезе, используются внешние дисмургационные быстроотвердевающие повязки, которые дополнительно иммобилизируют поврежденную конечность. Однако, иногда после операции, встает вопрос об общей фиксации животного, так как птица продолжает двигаться, а в силу индивидуальных травматических особенностей перелома трубчатых костей иногда, это крайне нежелательно. Тогда требуется максимально иммобилизировать животное на время, необходимое для полного сращения поврежденной конечности. Для этого используется вывешивание птицы после операции в специальных «люльках», или специфических птичьих кроватях. Цель этого – дать возможность птицам разминать конечности, не давая при этом дополнительных нагрузок на поврежденную конечность. Время, проведенное птицей на таких хирургических растяжках, может растянуться до 3-х месяцев. Собирать птичьи хирургические кровати можно из любых подручных средств, устанавливая рамные деревянные или иные конструкции, с применением вместо матраца плотной дышащей материи с прорезями для лап с фиксацией сверху тела птицы другой материей. Регуляция высоты хирургической птичьей кровати производится с учетом длины ног – птица должна лишь слегка дотрагиваться до пола пальцами своих лап.
И второй вариант, связанный с быстрой иммобилизацией птицы – это использование такой же конструкции, только в виде гамака, использующего в качестве опоры окружающие предметы и стены.
Общие принципы техники хирургических операций
применяемых нами на белых аистах.


Добавить комментарий