Статья поступила в редакцию 25.09.2019 г.
УДК 597.8
Валуев В.А.
Институт экологической экспертизы и биоинформационных технологий.
Республика Башкортостан, Уфимский район, 450571, с. Юматово, ул. Парковая, д. 36.
E-mail: ValuyevVA@mail.ru
// Материалы по флоре и фауне Республики Башкортостан. 2019. Вып. 24. С. 21-30.
Секреты амфибий способны подавлять жизнедеятельность некоторых кожных грибков. Изготовленные по одной технологии из различных видов они оказывают аналогичное, но, всё же, разное воздействие. Кожный грибок вырабатывает противоядие от секрета амфибий, воздействующего в данный момент на него, но применение секрета другого вида амфибии, сразу действует на него угнетающе.
Ключевые слова: амфибии, микоз, лечение.
Воздействие секретов амфибий на позвоночных животных известно уже много лет (Шварц и др., 1976; Пястолова, 1977; Сурова, 1982; Геворкян, 2012). Благодаря исследованиям этих учёных стало известно о пагубном воздействии их секретов, выделяемых в окружающую среду. Зарубежные фармакологи взяли это за основу разработок препаратов, которыми они предполагают бороться с различными болезнями (Nascimento et al., 2003; Ponti et al., 2003; Conlon et al., 2004; Morton et al., 2007; Keymanesh et al., 2009; Gibble., Baer, 2011; Mechkarska et al., 2014 и многие другие). Особенно интенсивно это направление стали изучать в последнее десятилетие.
В России башкирские учёные провели опыты по влиянию секретов озёрной лягушки Rana ridibunda Pallas, 1771 (синоним Pelophylax ridibundus) на растения и почвенные микроорганизмы, выявив различные воздействия на них; как летальные, так и животворящие (Валуев, 2013, 2019; Валуев и др., 2015, 2016; Калимулина, Григориади, 2013). Это подвигнуло нас провести опыты по выявлению возможного лечебного воздействия секретов амфибий на микоз.
Материалы и методы
В качестве доноров секретов были выбраны озёрная Pelophylax ridibundus и остромордая Rana arvalis лягушки. Основа для препарата – водопроводная вода села Санаторий Юматово Уфимского района Республики Башкортостан. Подсолнечное масло; для проведения опыта по влиянию секретов озёрной лягушки на микроаэрофилов. Полиэтиленовые твёрдые флаконы с крышками. Террариум для содержания амфибий вне опыта и посуда для содержания их при опыте. Лабораторные столы, компьютер, живые корма, осветительные и нагревательные приборы, водный и воздушный термометры; лупы от двух до двадцатикратного увеличения с подсветкой; мерные пробирки и прочая лабораторная посуда.
Препарат для подавления кожных грибков приготавливали следующим образом. В стеклянную трёхлитровую банку налили один литр водопроводной воды и поместили туда восемь остромордых лягушек. На третьи сутки, когда одна из них стала так плохо себя чувствовать, что переворачивалась на спину, амфибий вынули, а препарат профильтровали через марлю. Данный препарат мы приняли за 100%; в опыте применялся его 0,01% водный раствор. В данной статье мы обозначим этот препарат АМФкп0,0119врОсЛ, в отличие от АМФкп0,0115врОЛ – препарата полученного похожим образом из озёрной лягушки (тоже 0,01%) в 2015 году. АМФкп10015крОЛ, АМФкп115крОЛ и АМФкп0,0115крОЛ – эмульсии подсолнечного масла в равной пропорции с водными растворами 100, 1 и 0,01 процентной концентрации; настоянные, с периодическим взбалтыванием, в течение 6 суток.
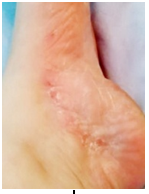
Фото 1. Стопа поражённая рубромикозом.
Из нескольких больных, в том числе и тех, кто уже потерял надежду вылечиться, например, с тяжёлой формой течения болезни, такой как рубромикоз (фото 1) выбрали, пациента с наименьшим очагом поражения грибком (фото 2).
В данном случае мы стали проводить опыт с начинающим прогрессировать микозом между пальцами ног.
История болезни
После двенадцатидневного лечения большой раны между 2-м и 3-м пальцами стопы препаратом АМФкп0,0115врОЛ, у больного остался лёгкий зуд в пальцах. Между пальцами по 4 раза в сутки помещали смоченные ватные тампоны и обёртывали пальцы, смоченной в том же растворе, полоской ткани.
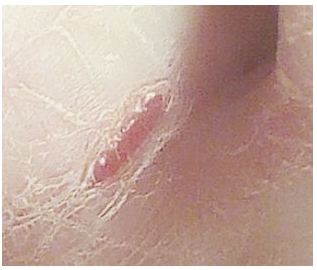
В 3 часа ночи 27 сентября, в новом месте среднего пальца, а именно на его сгибе, образовалась кровавая рана и зуд. Смоченные в этом препарате тампоны и ткань накладывали на пораженное место в 3²º и в 6ºº. В 8ºº рана затянулась (фото 2). Повязку и тампон сняли, дав ноге отдохнуть. В 9-00 ватный тампон обмотали вокруг пальца и закрепили тканью. Зуд исчез. Через несколько часов рана вновь открылась.
Фото 2. За 5 часов кровоточивая рана затянулась.
28 и 29 сентября она, время от времени, напоминала о себе острой болью (видимо, сказывалось положение её на сгибе) и не затягивалась. В ночь с 29-го на 30-е применили эмульсию АМФкп0,0115крОЛ. Утром 30 сентября, после сна, раздражение не чувствовалось. Но после, при ходьбе, – ранка засаднила. В 8ºº опять смазали её АМФкп0,01115крОЛ и приложили к ней смоченную этой же эмульсией ватку, закрепив полоской ткани. Зуд исчез. В 11-30 – тампон и повязку заменили. Зуд не появлялся.
В девять часов вечера 30 сентября появилась точечная ранка между 2 и 3 пальцами на верхней стороне левой стопы (на месте зажившей раны) около 1 мм в диаметре. Смазали АМФкп0,0115крОЛ (тампон, повязка).
Утром 1 октября стало понятно, что эта эмульсия не помогает; снова появился зуд, ранка между 2 и 3 пальцами на поверхности стопы стала больше. Опять стали применять водный раствор АМФкп0,0119врОсЛ.
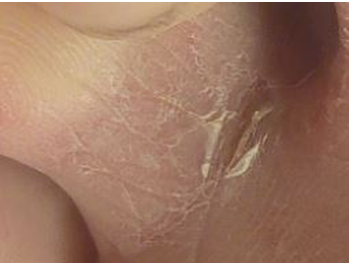
Фото 3. Утро 2.10.2019 г.
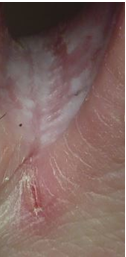
2 октября ранка на сгибе 3-го пальца затянулась (фото 3), а вновь образовавшаяся, наоборот, увеличилась; и это несмотря на то, что мы и на неё в эти дни прикладывали тампон с этим же раствором (фото 4).
Утром третьего октября ранка на сгибе пальца почти уже не замечалась, а на верхней части стопы ещё больше увеличилась (фото 5), распространяясь внутрь межпальцевого пространства.
Таким образом, препарат АМФкп0,0119врОсЛ за трое суток залечивший ранку на сгибе пальца, не смог остановить развитие той же болезни практически на том же пальце также в течение трёх суток. Начался зуд и боль при нажатии на верхнюю часть 2-го и 3-го пальцев.
Фото 4. Утро 2.10.2019 г.
Появилось предположение, что грибки привыкают к применяемому препарату.
Фото 5. Утро 3.10.2019 г.
Поэтому 2 октября вновь применили АМФкп0,0115врОЛ. Утром 4 октября рана зажила (фото 6).
Фото 6. Зажившая рана при использовании АМФкп0,0115врОЛ.
Предлагаем вниманию информацию об эмульсиях на основе водного препарата озёрной лягушки. На фото № 7, представлены эмульсии подсолнечного масла с разной концентрацией секрета озёрной лягушки, полученной в 2015 году.
Фото 7. Эмульсии с разной концентрацией секрета озёрной лягушки.
В каждый флакон налили по 50 мл масла и водного раствора. Во флаконе справа (со 100% водным раствором) на второй день пространство с маслом увеличилось, сократив объём водного раствора (рис. 7).
Через неделю, во флаконе со 100% водным раствором эмульсии, между водным раствором и маслом невооружённым глазом можно было видеть грязно-серую субстанцию с черноватыми вкраплениями (рис. 8 и 9).
Фото 8. Включения в эмульсии со 100% секретом озёрной лягушки.
Фото 9. Увеличенный фрагмент фото № 8.
Появился болотный запах, который при взбалтывании усиливался во много раз, создавая впечатление нахождения непосредственно на болоте. Во флаконах с 1% и 0,01% секретами таких включений не было; отсутствовал и болотный запах.
Зачем мы это делаем, если, как указывалось выше, угнетения грибка замечено не было? Отвечаем. У кролика возник конъюнктивит. Смачивали глаз АМФкп0,0115врОЛ (водный раствор). Но т.к., в силу обстоятельств, не получалось быть постоянно рядом с кроликом, а водный раствор быстро исчезал (скатывался, испарялся и т.п.), то было решено попробовать приготовить препарат в виде эмульсии, с целью более длительного пребывания препарата на очаге поражения. Приготовленный по вышеуказанной методике препарат излечил конъюнктивит за одно применение. Когда мы вернулись из поездки, глаз стал абсолютно здоровым (фото 10, 11).
Фото 10. Больной глаз. Фото 11. Здоровый глаз.
Поэтому опыты по разработке эмульсий секретов амфибий на базе растительных масел имеют право быть.
Выводы
-
Секреты озёрной и остромордой лягушек могут подавлять микоз.
-
Кожные грибки в течение двух-трёх суток привыкают к используемым препаратам АМФкп0,0115врОЛ и АМФкп0,0119врОсЛ.
-
Смена секретов разных видов амфибий, помогает избегать привыкания грибка к препаратам.
-
Эмульсия АМФкп0,0115крОсЛ устраняет зуд, но не оказывает видимого угнетающего воздействия на грибок.
-
Эмульсии с 1% и 0,01% секретами озёрной лягушки подавляют развитие анаэробных микроорганизмов; 100% – нет.
Литература
Валуев В.А. Влияние экзометаболитов озёрной лягушки Rana ridibunda на обработанное 0,1% хлором зерно пшеницы // Научные исследования и их практическое применение. Современное состояние и пути развития «2013»: Сб. науч. тр. SWorld. Одесса, 2013. Т. 38. № 1. С. 38-40.
Валуев В.А. Опыт с противогрибковым препаратом АМФкп0,01гк15врОЛ // Материалы по флоре и фауне Республики Башкортостан. 2019. № 24. С. 21-29
Валуев В.А., Загорская В.В., Книсс В.А., Хабибуллин В.Ф. Воздействие экзометаболитов амфибий разной концентрации на развитие семян ячменя // Материалы по флоре и фауне Республики Башкортостан. 2015. № 6. С. 4-6.
Валуев В.А. , Загорская В.В., Книсс В.А., Назаров В.С., Хабибуллин В.Ф. Влияние экзометаболитов озёрной лягушки Rana ridibunda (Pall.) на развитие ячменя Hordeum vulgare L. // Экология урбанизированных территорий. 2016. № 4. С. 6-11.
Геворкян В.С. Воздействие экзометаболитов на позвоночных, на примере лягушки травяной Rana temporaria // Альманах Пространство и Время. 2012. Т. 1. № 1. Спец. выпуск «Система планета Земля». C. 1-10.
Калимуллина А.Р., Григориади А.С. Влияние кожных выделений Rana ridibunda на микробиологическую и ферментативную активность серой лесной почвы // Современные проблемы биохимии и биотехнологии: мат-лы конф. Уфа: БашГУ, 2013. С.115-117.
Пястолова О.А. Влияние экзометаболитов на раннее развитие амфибий // Эколого-физиологические исследования в природе и эксперименте. Фрунзе, 1977. С. 150.
Сурова Г.С. Влияние группы на темпы роста и развития головастиков Rana temporaria и пластичность онтогенеза // Зоол. журн. 1982. Т. 61. № 5. С. 726—733.
Шварц С.С., Пястолова О.А, Добринская Л.А., Рункова Г.Г. Эффект группы в популяциях водных животных и химическая экология. М.: Наука, 1976. 151 с.
Conlon, J.M., J. Kolodziejek & N. Nowotny. Antimicrobial peptides from ranid frogs: taxonomic and phylogenetic markers and a potential source of new therapeutic agents // Biochim. Biophys. 2004. Acta 1696. P. 1–14.
Gibble R. E., Baer K. N. Effects of atrazine, agricultural runoff, and selected effluents on antimicrobial activity of skin peptides in Xenopus laevis // Ecotoxicol. and Environ. Safety. 2011. Vol. 74(4). P. 593-599.
Keymanesh K., Soltani S., Sardari S. Application of antimicrobial peptides in agriculture and food industry // World J. Microbiol. and Biotech. 2009. Vol.25(6). P. 933-944.
Mechkarska, M. , Attoub, S. , Sulaiman, S. , Pantic, J. , Lukic, M. L. , Michael Conlon, J. Anti-cancer, immunoregulatory, and antimicrobial activities of the frog skin host-defense peptides pseudhymenochirin-1Pb and pseudhymenochirin-2Pa // Regulatory Peptides. 2014. Vol.194-195. P. 69-76.
Morton, C.O., S.C. Dos Santos & P. Coote. An amphibian-derived, cationic, alpha-helical antimicrobial peptide kills yeast by caspase-independent but AIF-dependent programmed cell death // Mol. Microbiol. 2007. Vol. 65: P. 494–507.
Nascimento A.C.C., Fontes W., Sebben, A., Castro M.S. Antimicrobial peptides from anurans skin secretions // Protein and Peptide Letters. 2003. 10 (3). P. 227-238.
Ponti, D., Mangoni M. L., Mignogna G., Simmaco M., Barra, D. An amphibian antimicrobial peptide variant expressed in Nicotiana tabacum confers resistance to phytopathogens // Bioch. J. 2003. Vol. 370(1). P. 121-127.